关于作者
中国科学院老科学家科普演讲团副团长;中国科学院微生物研究所研究员,博士生导师,中国科学院研究生院教授;中国生物工程学会继续教育工作委员会主任、工业与与环境委员会委员,中国生物化学与分子生物学学会工业生化委员会委员,中国微生物学会酶与酶工程委员会委员。主要从事酶学、酶工程、基因工程和生化工程研究。
话说青霉素四:精益求精
孙万儒
2011年08月18日
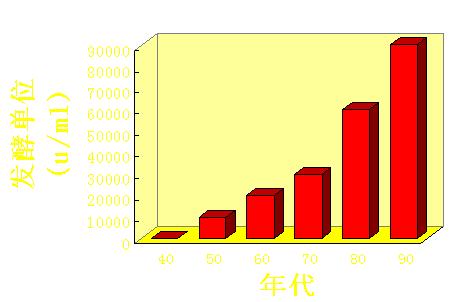
虽然青霉素可以工业生产了,但这种生产水平与现在的生产水平无法相比。现在青霉素工业生产使用的发酵罐最大的可达300立方米,生产过程全部由计算机控制,青霉素的发酵水平达到每毫升发酵液7-8万单位,实验性的发酵水平达到每毫升发酵液10万单位,从发酵液中提取出青霉素,制成产品的收率为90-95%,产品纯度99.9%以上。仅就青霉素的发酵水平的变化图就可以看到,几乎是每十年青霉素的发酵酵价增加一倍。
青霉素产业化到现在也就是半个多世纪,而这半个多世纪里,科学技术的发展突飞猛进,极大地推/带动了青霉素工业的发展。前三十年的生产水平的提高主要依赖于微生物学、遗传学、生物化学和发酵工程学的发展。首先是生产菌种发生了巨大变化,人们在自然界广泛收集产生青霉素的微生物菌种,不断地进行对比、选择,筛选到生产水平更高的产青霉素菌种。然后,根据经典遗传学的方法,采用各种物理、化学诱变和无性杂交手段,对菌种进行改造,使菌种的产青霉素水平不断提高;另外,根据菌种的生理特性和青霉素合成代谢的特点不断改善培养基成分,投其所好,使青霉素的发酵水平逐步上升。
随着人们对青霉菌的生理、生化特性研究的不断深入,对青霉素在细胞内的合成过程也了解的越来越多,人们根据这些特点采取了各种有针对性的措施,限制其对产生青霉素不利的因素,充分发挥、调动有利因素,不断优化发酵和提取的条件,在发酵设备、工艺、技术上采取相应措施,是上个世纪七、八十年代以前青霉素发酵和生产水平不断地大幅度提高的主要原因。
比如发现葡萄糖虽然是菌种生长和合成青霉素必须的碳源,但是过多的葡萄糖会产生抑制作用,特别是对青霉素的产生不利。因此在发酵过程中随着葡萄糖不断的被菌体利用消耗而采取了不断的流加补充葡萄糖的方法,保持葡萄糖浓度处于低水平,既能够满足青霉菌生长和青霉素合成的需要,又不会产生不利影响,从而使菌体生长和青霉素的合成水平大幅度提高。
对青霉素的化学结构的研究发现,青霉素是由两部分,即青霉素母核和侧链组成。由不同的菌种产生的青霉素虽然有差别,但母核是相同的,差别只在侧链上,比如青霉素g的侧链是苯乙酸,而青霉素v的侧链是苯氧乙酸。对青霉素在细胞内合成过程的研究发现,构成青霉素g和v不可缺少的侧链前体在菌体细胞内合成速度比较缓慢,成为合成青霉素的瓶颈,因此人们想到,在发酵时添加必须的侧链苯乙酸或苯氧乙酸是否可以提高青霉素的合成速度和产量呢?实际的研究结果证明,确实如此。于是人们又研究什麽时候加,加多少,怎样加等等问题,随着侧链添加工艺的不断改进和完善,青霉素的发酵水平不断的上升。
对在青霉素合成途径研究时发现,与赖氨酸的合成过程有关系,赖氨酸生物合成的一个中间体 -氨基己二酸参与青霉素合成。而赖氨酸合成过程中,如果赖氨酸合成多了时,赖氨酸会回过头来对其本身的合成过程的第一个酶高柠檬酸合成酶的产生反馈抑制作用,这就限制了 -氨基己二酸的生成,从而间接地抑制青霉素的合成。如果在青霉素发酵过程中加入 -氨基己二酸,可减少赖氨酸的抑制作用,也就提高青霉素的产量。这一发现又为提高青霉素的发酵水平开辟了一个新的途径。
详细研究青霉素发酵过程中,温度对菌体生长、发酵水平的影响时发现,总体上菌体生长的最适温度为30 ,青霉素合成的最适温度为20 。根据计算机模拟对发酵最适温度的计算得出结论,青霉素发酵的最适温度是在最初的5小时维持30 ,在较高的温度下可加快细胞成长,缩短发酵开始时细胞适应新环境的时间;随后发酵温度降低到25 ,发酵35小时,控制菌丝生长和代谢水平;再降低发酵温度到20 ,发酵85小时,可以促进青霉素的合成;最后发酵温度回升到25 继续发酵40小时,然后结束发酵,放罐。最后提高发酵温度的目的在于促进发酵产物青霉素从细胞内释放到发酵液中。采用这种变温发酵,使发酵过程的细胞生长和产物合成阶段均处于最适温度条件下,其青霉素的产量要比以前的25 恒温发酵的产量高14.7%。
人们就是通过这样的一点一滴的详细研究的积累,不断加深对菌种和青霉素合成过程的的认识,不断改进、完善发酵和提取的工艺、技术和设备,到上个世纪八十年代青霉素的发酵达到了每毫升发酵液六、七万单位的水平。
随着人们对青霉菌的生理、生化特性研究的不断深入,对青霉素在细胞内的合成过程也了解的越来越多,人们根据这些特点采取了各种有针对性的措施,限制其对产生青霉素不利的因素,充分发挥、调动有利因素,不断优化发酵和提取的条件,在发酵设备、工艺、技术上采取相应措施,是上个世纪七、八十年代以前青霉素发酵和生产水平不断地大幅度提高的主要原因。
比如发现葡萄糖虽然是菌种生长和合成青霉素必须的碳源,但是过多的葡萄糖会产生抑制作用,特别是对青霉素的产生不利。因此在发酵过程中随着葡萄糖不断的被菌体利用消耗而采取了不断的流加补充葡萄糖的方法,保持葡萄糖浓度处于低水平,既能够满足青霉菌生长和青霉素合成的需要,又不会产生不利影响,从而使菌体生长和青霉素的合成水平大幅度提高。
对青霉素的化学结构的研究发现,青霉素是由两部分,即青霉素母核和侧链组成。由不同的菌种产生的青霉素虽然有差别,但母核是相同的,差别只在侧链上,比如青霉素g的侧链是苯乙酸,而青霉素v的侧链是苯氧乙酸。对青霉素在细胞内合成过程的研究发现,构成青霉素g和v不可缺少的侧链前体在菌体细胞内合成速度比较缓慢,成为合成青霉素的瓶颈,因此人们想到,在发酵时添加必须的侧链苯乙酸或苯氧乙酸是否可以提高青霉素的合成速度和产量呢?实际的研究结果证明,确实如此。于是人们又研究什麽时候加,加多少,怎样加等等问题,随着侧链添加工艺的不断改进和完善,青霉素的发酵水平不断的上升。
对在青霉素合成途径研究时发现,与赖氨酸的合成过程有关系,赖氨酸生物合成的一个中间体 -氨基己二酸参与青霉素合成。而赖氨酸合成过程中,如果赖氨酸合成多了时,赖氨酸会回过头来对其本身的合成过程的第一个酶高柠檬酸合成酶的产生反馈抑制作用,这就限制了 -氨基己二酸的生成,从而间接地抑制青霉素的合成。如果在青霉素发酵过程中加入 -氨基己二酸,可减少赖氨酸的抑制作用,也就提高青霉素的产量。这一发现又为提高青霉素的发酵水平开辟了一个新的途径。
详细研究青霉素发酵过程中,温度对菌体生长、发酵水平的影响时发现,总体上菌体生长的最适温度为30 ,青霉素合成的最适温度为20 。根据计算机模拟对发酵最适温度的计算得出结论,青霉素发酵的最适温度是在最初的5小时维持30 ,在较高的温度下可加快细胞成长,缩短发酵开始时细胞适应新环境的时间;随后发酵温度降低到25 ,发酵35小时,控制菌丝生长和代谢水平;再降低发酵温度到20 ,发酵85小时,可以促进青霉素的合成;最后发酵温度回升到25 继续发酵40小时,然后结束发酵,放罐。最后提高发酵温度的目的在于促进发酵产物青霉素从细胞内释放到发酵液中。采用这种变温发酵,使发酵过程的细胞生长和产物合成阶段均处于最适温度条件下,其青霉素的产量要比以前的25 恒温发酵的产量高14.7%。
人们就是通过这样的一点一滴的详细研究的积累,不断加深对菌种和青霉素合成过程的的认识,不断改进、完善发酵和提取的工艺、技术和设备,到上个世纪八十年代青霉素的发酵达到了每毫升发酵液六、七万单位的水平。